Temat badania kału na obecność pasożytów jest wciąż aktualny i budzi wiele pytań. Aby rozwiać wątpliwości przygotowaliśmy porównanie najczęstszych metod diagnostycznych wykorzystywanych do wykrywania pasożytów z kału. Porównanie opiera się na analizie ogólnodostępnych publikacji naukowych. Zachęcamy do lektury!
Uwaga: Ważne są także inne czynniki, takie jak: czas pobrania próbki, sposób jej przechowywania i transportu, jakość sprzętu i reagentów laboratoryjnych, doświadczenie i umiejętności personelu wykonującego badanie. Wszystkie te elementy mogą wpływać na jakość i dokładność diagnozy.
Metody badania kału:
- Badanie kału metodą iFA (immunofluorescencja pośrednia) polega na wykrywaniu antygenów pasożytów w kale. Szybka i skuteczna.
- Badanie kału metodą ELISA (Enzyme-Linked Immunosorbent Assay) jest techniką immunoenzymatyczną, która pozwala na wykrycie w kale antygenów pasożyta. Jest to metoda o większej czułości niż mikroskopowa analiza kału, która musi być wykonywana niekiedy w próbkach pobieranych przez 8 do 10 kolejnych dni, lub nawet dłużej, z uwagi na okresowe wydalanie cyst. Czasochłonna lecz skuteczna.
- Immunofluorescencja bezpośrednia (IFA) to technika diagnostyczna, która polega na wykorzystaniu przeciwciał znakowanych fluorescencyjnie do wykrywania antygenów w próbkach biologicznych, takich jak krew, mocz czy kał. Skuteczna lecz czasochłonna i skomplikowana. Wymaga specjalistycznego sprzętu i przeszkolonego personelu.
- Badanie kału metodą PCR (Reakcja Łańcuchowa Polimerazy) jest techniką molekularną, która polega na amplifikacji (powielaniu) specyficznych sekwencji DNA charakterystycznych dla poszukiwanego gatunku pasożyta. Szybka i skuteczna. Wymaga specjalistycznego sprzętu i przeszkolonego personelu.
- Badanie kału metodą koncentracji służy do wykrywaniu jaj lub cyst pasożytów w kale. W tym celu stosuje się różne metody, takie jak metoda Baermanna, Ritchie’ego, czy Fulleborna (ZCF) a następnie preparat oglądany jest pod mikroskopem optycznym. Czasochłonna, o niższej skuteczności niż pozostałe metody badawcze. Wymaga bardzo doświadczonego personelu.
Artykuł 1: “Comparative study of a broad qPCR panel and centrifugal flotation for detection of gastrointestinal parasites in fecal samples from dogs and cats in the United States”.
porównuje skuteczność dwóch metod diagnostycznych: mikroskopii po zastosowaniu dwóch metod koncentracji kału (ZCF) oraz reakcji łańcuchowej polimerazy (PCR) w wykrywaniu pasożytów Giardia duodenalis i Entamoeba histolytica w próbkach kału.
Zgodnie z metodologią, badanie PCR, które jest testem złotym standardem, przeprowadzono na próbkach kału podejrzanych o obecność G. lamblia i E. histolytica. Następnie na tych samych próbkach przeprowadzono badanie mikroskopowe, a wyniki obu testów porównano.
Wyniki pokazały, że PCR wykrył znacznie wyższą ogólną częstość pasożytów (n = 679) w porównaniu do metody mikroskopowej po zastosowaniu ZCF (n = 437) oraz 2,6 razy więcej współinfekcji [PCR (n = 172) vs. ZCF (n = 66)
Wnioski z badania sugerują, że PCR ma znaczącą przewagę w wykrywaniu częstości pasożytów w porównaniu do rutynowego badania mikroskopowego ZCF zarówno dla pojedynczych infekcji, jak i współinfekcji.

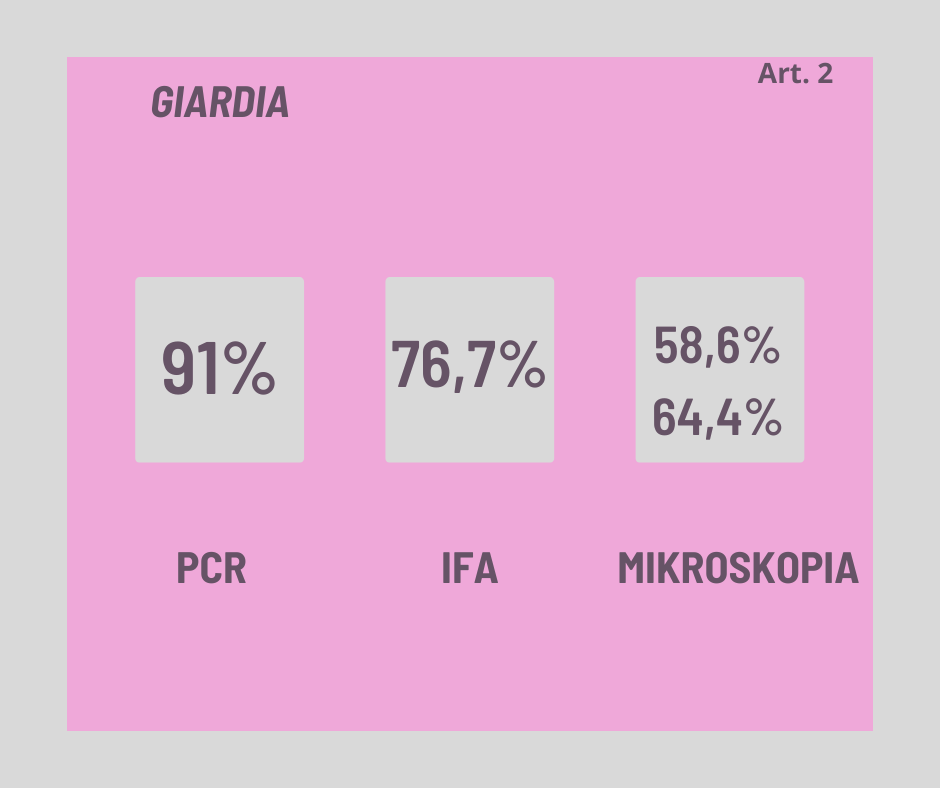
Artykuł 2: “Comparison of sensitivity and specificity of 4 methods for detection of Giardia duodenalis in feces: immunofluorescence and PCR are superior to microscopy of concentrated iodine-stained samples”
Cel badania: Porównać skuteczność mikroskopii po zastosowaniu dwóch metod koncentracji kału oraz immunofluorescencji (IFA) i reakcji łańcuchowej polimerazy (PCR) w wykrywaniu Giardia duodenalis w ludzkim kale.
Wyniki: IFA i PCR były znacznie bardziej czułe i specyficzne niż mikroskopia. IFA wykryła 76,7% próbek pozytywnych, a PCR 91%. Mikroskopia po zastosowaniu 2 metod koncentracji wykryła odpowiednio tylko 58,6% i 64,4% próbek pozytywnych.
Wnioski: IFA i PCR są lepszymi metodami diagnostycznymi niż mikroskopia skoncentrowanych próbek barwionych jodem.
Artykuł 3: “Performance of microscopy and ELISA for diagnosing Giardia duodenalis infection in different pediatric groups”
Cel badania: Porównać skuteczność mikroskopii i metody ELISA w diagnozowaniu zakażenia Giardia duodenalis u różnych grup dzieci z i bez problemów zdrowotnych.
Zastosowano dwie metody diagnostyczne: mikroskopię po zastosowaniu dwóch metod koncentracji kału oraz ELISA do wykrywania antygenu Giardia, Cryptosporidium sp. i Entamoeba histolytica. Porównano wyniki obu metod.
Wyniki: ELISA wykazała większą czułość niż mikroskopia (97% vs. 55%) w wykrywaniu zakażenia G. duodenalis. ELISA była również bardziej czuła w wykrywaniu innych pasożytów: Cryptosporidium sp. (100% vs. 0%) i E. histolytica (100% vs. 50%).
Wnioski: ELISA jest bardziej czułą metodą niż mikroskopia w diagnozie zakażenia G. duodenalis.

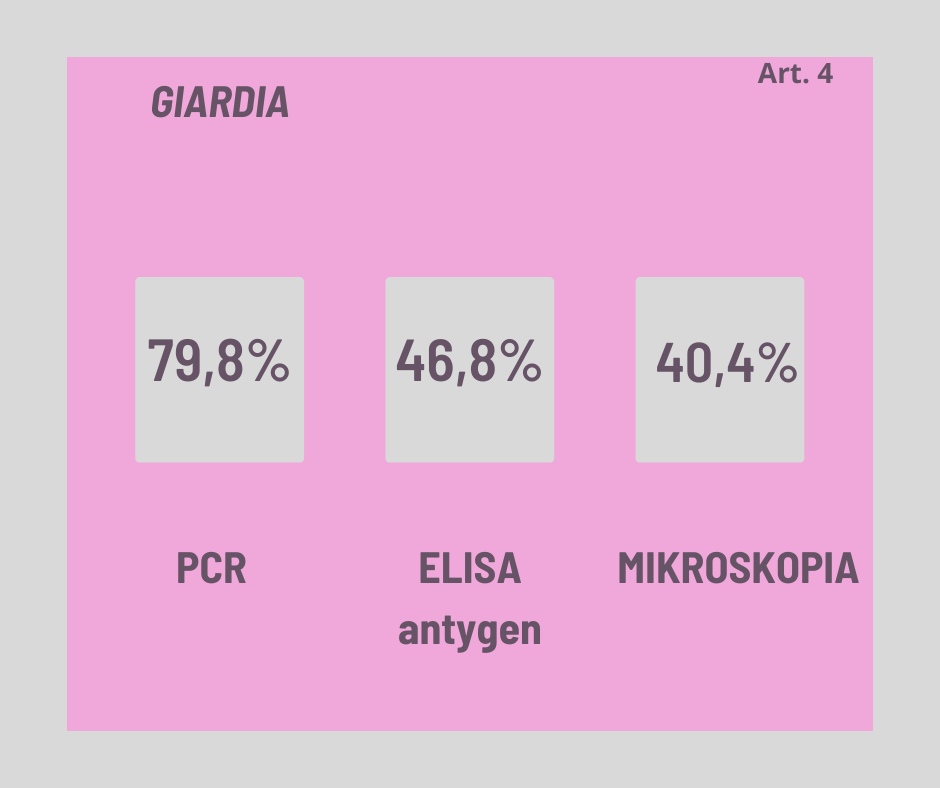
Artykuł 4: „ Comparison of microscopy, ELISA, and real-time PCR for detectionof Giardia intestinalis in human stool specimens”
porównuje skuteczność trzech metod diagnostycznych: mikroskopii, ELISA i real-time PCR (RT-PCR) w wykrywaniu zakażenia Giardia intestinalis w próbkach kału.
Cel badania: Badanie przeprowadzono na pacjentach, którzy mieli dolegliwości związane z układem pokarmowym. Celem badania było porównanie konwencjonalnej mikroskopii z zestawem do wykrywania antygenów za pomocą ELISA i techniką RT-PCR do wykrywania Giardia intestinalis w próbkach kału.
Wyniki: Ogółem przebadano 94 próbki kału, z czego 38 zdiagnozowano jako pozytywne (40,4%) i 56 jako negatywne za pomocą mikroskopii.
Zgodnie z wynikami badań, prawie połowa (46,8%) próbek kału była pozytywna na obecność G. intestinalis według testu ELISA, a prawie 80% (79,8%) według testu RT-PCR.
W porównaniu do PCR, czułość i swoistość mikroskopii wynosiła odpowiednio 50,7% i 100% natomiast ELISA : 53,3% i 79%1.
Wnioski: RT-PCR wydaje się być znacznie bardziej czułą metodą i jest korzystna dla szybkiej i dokładnej diagnozy G. intestinalis w ludzkich próbkach kału.
Artykuł 5: “Comparison of PCR and Microscopy for Detection of Cryptosporidium parvum in Human Fecal Specimens: Clinical Trial”
porównuje skuteczność PCR i mikroskopii w wykrywaniu zakażenia Cryptosporidium parvum w ludzkich próbkach kału.
Cel badania: Porównać PCR, który jest nowoczesną techniką molekularną, z konwencjonalną mikroskopią z użyciem barwnika kwasoopornego w diagnozie kryptosporidiozy. Badanie przeprowadzono na 511 próbkach kału pobranych od pacjentów z biegunką.
Wyniki: PCR wykrył 36 próbek pozytywnych na obecność C. parvum, podczas gdy mikroskopia wykryła tylko 29 próbek pozytywnych. Dodatkowo, PCR był w stanie odróżnić dwa genotypy C. parvum: ludzki i bydlęcy, na podstawie wielkości produktu PCR. Mikroskopia była mniej czuła i specyficzna niż PCR (83,7% i 98,9% odpowiednio).
Wnioski: PCR jest lepszą metodą diagnostyczną niż mikroskopia w wykrywaniu C. parvum w ludzkich próbkach kału. PCR jest również przydatny w określaniu źródła zakażenia kryptosporidiowym poprzez różnicowanie genotypów pasożyta.

Literatura:
- Leutenegger CM, Lozoya CE, Tereski J, Andrews J, Mitchell KD, Meeks C, Willcox JL, Freeman G, Richmond HL, Savard C, Evason MD. Comparative study of a broad qPCR panel and centrifugal flotation for detection of gastrointestinal parasites in fecal samples from dogs and cats in the United States. Parasit Vectors. 2023 Aug 16;16(1):288. doi: 10.1186/s13071-023-05904-z. PMID: 37587483; PMCID: PMC10433665.
- Gotfred-Rasmussen H, Lund M, Enemark HL, Erlandsen M, Petersen E. Comparison of sensitivity and specificity of 4 methods for detection of Giardia duodenalis in feces: immunofluorescence and PCR are superior to microscopy of concentrated iodine-stained samples. Diagn Microbiol Infect Dis. 2016 Mar;84(3):187-90. doi: 10.1016/j.diagmicrobio.2015.11.005. Epub 2015 Nov 10. PMID: 26707069.
- Silva RK, Pacheco FT, Martins AS, Menezes JF, Costa-Ribeiro H Jr, Ribeiro TC, Mattos ÂP, Oliveira RR, Soares NM, Teixeira MC. Performance of microscopy and ELISA for diagnosing Giardia duodenalis infection in different pediatric groups. Parasitol Int. 2016 Dec;65(6 Pt A):635-640. doi: 10.1016/j.parint.2016.08.012. Epub 2016 Aug 30. PMID: 27586394.
- Beyhan YE, Taş Cengiz Z. Comparison of microscopy, ELISA, and real-time PCR for detection of Giardia intestinalis in human stool specimens. Turk J Med Sci. 2017 Aug 23;47(4):1295-1299. doi: 10.3906/sag-1612-71. PMID: 29156877.
- Morgan UM, Pallant L, Dwyer BW, Forbes DA, Rich G, Thompson RC. Comparison of PCR and microscopy for detection of Cryptosporidium parvum in human fecal specimens: clinical trial. J Clin Microbiol. 1998 Apr;36(4):995-8. doi: 10.1128/JCM.36.4.995-998.1998. PMID: 9542924; PMCID: PMC104676.